Entrez un mot ou une phrase dans n'importe quelle langue 👆
Langue:
Traduction et analyse de mots par intelligence artificielle ChatGPT
Sur cette page, vous pouvez obtenir une analyse détaillée d'un mot ou d'une phrase, réalisée à l'aide de la meilleure technologie d'intelligence artificielle à ce jour:
- comment le mot est utilisé
- fréquence d'utilisation
- il est utilisé plus souvent dans le discours oral ou écrit
- options de traduction de mots
- exemples d'utilisation (plusieurs phrases avec traduction)
- étymologie
Qu'est-ce (qui) est Простая связь - définition
Простая смерть (фильм); Простая смерть; Простая смерть...
Простая связь
ординарная связь, одинарная связь, химическая ковалентная связь, осуществляемая парой электронов (с антипараллельной ориентацией спинов), движущихся в поле 2 атомных ядер. Например, в молекулах H2, Cl2 и HCl имеется по одной ковалентной связи, образованной взаимодействием неспаренных электронов (находившихся на атомных орбиталях 1s-1s, 3р-3р и 1s-3р соответственно). Поскольку эти молекулы двухатомны, химические связи в них двухцентровые. Для указанных молекул можно написать следующие электронные и структурные формулы: Н: Н и Н-Н, Cl: Cl и Cl-Cl, H: Cl и Н-Cl [две точки и валентный штрих (чёрточка) обозначают пару электронов, общую для обоих соединившихся атомов].
Аналогичное описание справедливо для молекул всех насыщенных соединений, у которых число пар валентных электронов равно числу возможных двухцентровых взаимодействий. В таких соединениях все химические связи являются П. с. (с кратностью, равной единице). Пара электронов П. с. в равной степени может иметь и донорно-акцепторное происхождение (см. Донорно-акцепторная связь). Поэтому, например, изоэлектронные молекула CH4 и ионы 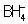 и
и 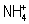 могут быть описаны однотипной структурной формулой
могут быть описаны однотипной структурной формулой
(где Х = В-, С и N+ соответственно).
В химических соединениях, в которых среднее число электронов, связывающих каждую пару атомных ядер, не равно двум, могут возникнуть химические связи самой различной кратности - как меньше единицы (соединения с дефицитом электронов), так и больше единицы (соединения с кратными связями (См. Кратные связи)). В этих случаях описание электронного строения молекул обычно требует привлечения наиболее общего метода квантовой химии - Молекулярных орбиталей метода.
Е. М. Шусторович.
Простая форма (кристаллография)
Простая форма — совокупность граней, выводящихся друг из друга элементами симметрии точечной группы и удовлетворяющая закону Гаюи.
Простая история
СТРАНИЦА ЗНАЧЕНИЙ
Простая история (фильм)
* Простая история (фильм, 1930) — советский короткометражный художественный фильм режиссёра Александра Столпера.
Wikipédia
Простая смерть…

«Простая смерть...» — фильм, поставленный Александром Кайдановским по мотивам повести Льва Толстого «Смерть Ивана Ильича». Дипломная работа Александра Кайдановского по окончании ВКСР, мастерская Сергея Соловьёва.
Exemples du corpus de texte pour Простая связь
1. Но к Интернету подключена лишь каждая третья сельская школа". Причем выход во Всемирную сеть имеют в основном райцентры, уже в 5 - 7 километрах от них часто не работает даже простая связь.

